A. Rumus Umum Alkohol
Senyawa turunan alkana yang memiliki
gugus hidroksil (-OH).
Rumus umum CnH₂n₊₂O
n = jumlah atom karbon
B. Tata Nama Alkohol
Tata Nama IUPAC
1. Rantai karbon terpanjang dengan cabang terbanyak yang mengandung gugus −OH ditetapkan sebagai rantai induk. Selanjutnya, rantai induk tersebut diberi nama dengan mengganti akhiran “-a” pada alkana menjadi “-ol”. Misalnya, etana menjadi etanol. n = jumlah atom karbon.
2. Penomoran dilakukan sedemikian sehingga atom C yang mengikat gugus −OH diprioritaskan mempunyai nomor yang sekecil mungkin.
Tata Nama Trivial
R ̶ OH : Alkil alkohol
Contoh:
C. Struktur Atom Alkohol
R ̶ OH ; R = Alkil dengan rumus (CnH₂n₊₁)
̶ OH = gugus fungsi alkohol
A. Sifat Fisika Alkohol
1. Titik didih alkohol lebih
tinggi dibanding dengan titik didih alkana yang mempunyai atom C yang sama. Hal
ini karena dalam keadaan cair molekul-molekul alkohol terasosiasi dan biasanya
membentuk jembatan.
2. Makin banyak atom C, makin
tinggi titik didihnya.
3. Bersifat polar karena memiliki gugus –OH.
4. Kelarutan alkohol dalam pelarut non
polar bertambah.
5. Mudah terbakar
Tabel 1. Sifat Fisika Alkohol
B. Sifat Kimia Alkohol
- Mudah untuk terbakar.
- Mudah dalam bercampur dengan tali karena mereka memiliki struktur yang mirip dengan air (H-OH) dan alkohol (R-OH).
- Dalam bentuk gas dan
air, jumlah atom karbon adalah satu hingga empat atom karbon, sedangkan
jumlah atom karbon adalah lima hingga sembilan setebal minyak.
- Alkohol mempunyai
sebuah titik didih di luar titik didih alkana karena gugus fungsi OH
sangat polar dan daya tarik antar molekul sangat kuat.
- Alkohol hetero-polar,
panjang rantai alkali dapat mempengaruhi polaritasnya, rantai alkil
mengurangi polaritas, yang mengarah pada kelarutan. Alkohol misalnya
dengan etanol dan metanol mudah larut dalam air.
Gugus –OH pada alkanol termasuk gugus yang cukup reaktif, sehingga menyebabkan alkanol banyak terlibat dalam berbagai reaksi.
1. Reaksi dengan Logam Natrium
Alkohol dapat bereaksi dengan logam Na membentuk alkoksida dan gas hidrogen. Contoh reaksi etanol dengan logam natrium.
2. Reaksi dengan Hidrogen Halida
Contoh reaksi:
3. Reaksi
Oksidasi Alkohol
Contoh :
Reaksi reduksi dari keton membentuk alkohol sekunder
Contoh :
Gambar 1. Larutan Metanol
Pertama adalah metanol, (CH3OH) sering juga disebut dengan alkohol kayu (wood alcohol) karena pada awalnya dibuat dari distilasi kering pada kayu. Proses pembuatan metanol secara sintesis di dunia industri dilakukan melaui reaksi antara karbon monoksida (CO) dan gas hidrogen (H2) pada temperatur dan tekanan tinggi. Reaksi pembuatan metanol ini menggunakan katalis, contohnya Fe2O3.
CO(g) + H2(g) → CH3OH
(dengan bantuan Fe2O3)
Metanol itu sangat beracun lho, bisa menyebabkan kebutaan.
Manfaat dari Metanol
- Metanol banyak digunakan sebagai bahan baku etanol dan bahan polimer.
- Metanol juga banyak digunakan sebagai pencampur bensin maupun spirtus.
- Sebagai bahan bakar, metanol mempunyai keunggulan dibandingkan bensin, yaitu proses pembakarannya bisa lebih sempurna, yaa tetapi biaya produksinya agak lebih mahal.
B. Etanol
Kedua adalah alkohol yang biasa kita sebut sehari – hari yaitu etanol, dengan rumus struktur C2H5OH. Etanol diproduksi dengan proses fermentasi karbohidrat, misalnya fermentasi ubi kayu yang sering disebut dengan pembuatan tape. Proses perubahan karbohidrat menjadi etanol dilakukan dengan bantuan enzim
Karbohidrat → C6H12O6 → 2CH3CH2OH + 2CO2(g) (dengan bantuan enzim)
Glukosa
etanol
Proses ini menghasilkan energi
yang dimanfaatkan oleh mikroorganisme untuk tumbuh dan berkembang biak. Proses
fermentasi tidak bisa menghasilkan etanol dengan konsentrasi tinggi. Hal ini
disebabkan pada konsentrasi alkohol lebih dari 15%, maka mikroorganisme akan
mati. Untuk itu, biasanya hasil proses fermentasi ditingkatkan konsentrasi
alkoholnya dengan teknik distilasi. Di dunia industri, etanol diproduksi secara
besar – besaran dengan reaksi adisi air dan etena pada temperatur 280oC dan
tekanan 300 atmosfer
CH2 = CH2 + H2O → CH3CH2OH (dengan katalis H2SO4)
Etena etanol
Manfaat Etanol :
1. Etanol
banyak digunakan sebagai pelarut organik dan antiseptik
2. Etanol
sebagai bahan baku untuk senyawa industri seperti pewarna, obat sintesis, bahan
kosmetik, bahan peledak, bahan bakar, dan minuman beralkohol (anggur dan bir).
3. Etanol
tidak bersifat racun, tetapi dalam jumlah yang banyak akan menyebabkan mabuk,
karena etanol bekerja dengan aktivitas otak.
4. Dampak
lain dari sistem kerja alkohol adalah mengakibatkan kecanduan.
C. Etilen Glikol dan Gliserol
Gambar 3. Larutan Etilen glikol
Kemudian yang ke tiga,
polialkohol yang mempunyai dua gugus –OH diberi nama alkanadiol, contohnya 1,2-etanadiol (etilen glikol), sedangkan
polialkohol dengan tiga gugus –OH diberi nama alkanatriol, contohnya 1,2,3-propanatriol (gliserol).
Etilen glikol atau biasa disebut
glikol termasuk alkohol alifatik dengan dua gugus hidroksil. Istilah
glikol berasal dari bahasa Yunani glykis yang berarti manis. Etilen glikol
merupakan zat cair tidak berwarna, larut dalam air, berasa manis, titik didih
198oC dan bersifat racun.
Manfaat polialkohol etilen glikol
:
1. Glikol
dapat membeku pada suhu rendah (-11,5 oC) sehingga glikol biasa
digunakan sebagai bahan anti beku pada radiator mobil.
2. Dalam
industri, etilen glikol digunakan sebagai pelarut cat, bahan pelembut, bahan
dasar industri serat sintesis seperti Dacron.
3. Etilen
glikol dapat diperoleh melalui reaksi oksidasi pada etilena, dilanjutkan dengan
hidrolisis pada suasana asam.
Gambar 4. Reaksi Pembentukan Gliserol
Gliserol berasal dari bahasa
Yunani "glykeros" yang berarti manis. Gilserol atau disebut juga
sebagai gliserin, merupakan zat cair kental dengan titik leleh 18oC dan titik
didih 290oC, bersifat higroskopis, dan berasa manis. Gliserol merupakan hasil
samping pembuatan sabun.
Manfaat Gliserol :
1. Gliserol adalah
obat untuk mengatasi konstipasi, batuk, dan kulit kering.
2. Selain itu,
gliserol atau gliserin juga dapat digunakan untuk meningkatkan kelembapan
kulit, serta menurunkan tekanan pada bola mata akibat glukoma.












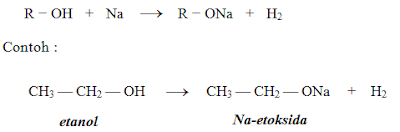















Tidak ada komentar:
Posting Komentar